背景:将PCR技术(聚合酶链式反应)与无创产前检测(NIPT)结合运用,可以精确定量母体血浆中的胎儿突变等位基因,从而实现对胎儿单基因疾病的检测。本研究研发并验证循环单分子扩增和重测序技术(circulating single-molecule amplification and resequencing Technology,cSMART)对血浆等位基因单分子计数的有效性,威尔逊疾病(Wilson Disease)被用于cSMART在无创产前的应用验证。
方法:通过Sanger法和全外显子组测序法辨别家族性ATP7B(ATP酶,Cu++转运,β多肽)基因突变。通过cSMART技术,对单分子进行独特的条形码标记并予以环化,然后通过反向PCR方法对等位基因进行定位和复制。通过测序计算独特的单个等位基因分子,使用原始母体血浆样品中突变等位基因的百分率来确定胎儿的基因型。
结果:四个具有WD家族病史的家族参加本研究。通过Sanger法和全外显子组测序法确定了每个家族的致病性ATP7B基因突变,并对WD先证者的患病原因进行了确认。通过模拟的血浆模型(模仿胎儿父亲、母亲或双亲等位基因突变的血浆模型)验证cSMART法之后,回顾性研究数据显示第二次妊娠取得了侵入性产前诊断和无创产前检测(NIPT)胎儿基因型一致的检测结果。
结论:我们研发了一种可靠且准确的无创产前检测新方法,并运用此方法准确确认了4例WD风险妊娠的胎儿基因型。运用此技术时需预先知晓父母的致病性突变,可在其他单基因疾病的无常产前检测中广泛使用。
目前主要通过绒毛取样或羊水穿刺提取胎儿细胞,并进行分子生物学分析来进行产前胎儿单基因病检测。对于具有家族病史的遗传突变分析或先证者患病分析,主要通过PCR法和Sanger测序法直接检测相应的致病性等位基因。若突变基因未知,则需要使用短串联重复序列(Short Tandem Repeats,STR)的连锁分析进行检测。上述方法在确定胎儿基因型方面可靠且准确,可为胎儿检测为患病的夫妇提供妊娠建议。全外显子测序技术可轻易识别任何单基因疾病的致病性突变,且在识别家族新发或稀有突变及对临床表型不清楚的个体进行诊断方面,也证明真实可靠。
除对常见染色体疾病进行成功的无创产前检测(NIPT)和在检测具有临床意义的拷贝数变异(8-10)方面很有前景之外,对这项技术明显的扩展之一就是对单基因疾病的准确检测(11)。但是,在母体血浆中出现循环低水平的无细胞胎儿DNA时,例如在怀孕11至17周时(12)低达每毫升25个染色体拷贝,平均166个碱基对,这时对于常规诊断方法的分析模板来说就构成了一个非常大的问题。尽管如此,已经通过数字PCR测量相对突变剂量证明了NIPT诊断单基因疾病的可能性(14),在与基因突变相关的主要血液疾病β-地中海贫血(15)、镰状细胞贫血(16)和血友病(17)以及确定RhD抗原基因型(18)的突变方面,使得相应检测成为可能。最近,在两例妊娠中成功使用了HBB(血红蛋白,β)5基因相对单倍型剂量分析结合数字PCR技术的检测方法,对存在β-地中海贫血风险的胎儿进行了正确的基因分型(19)。然而,虽然报告的结果显示存在较好的前景,但是对于大多数分子诊断实验室来说数字PCR仍然存在技术挑战(14),因此这项技术无法迅速应用于临床。目前,在临床上可以使用的方法只有通过靶向定量PCR开展的RHD(Rh血型,D抗原)基因外显子5、7和10的RhD分型无创产前检测(20),已经证明这种方法可以高度准确地测定胎儿存在RhD阳性(20,21)。
从首要原则和针对有创产前诊断开发的分子诊断获得的经验显示,对于血浆中随机分散的DNA分子进行准确定量测量的最合乎逻辑的方法仍然是直接等位基因靶向方法(13)。固定前向的常规PCR法和桥接多个突变位点的反向PCR引物法是目前正在开发的有效方法。然而,因为发现源自母体的DNA片段平均尺寸大于源自胎儿的片段(22,23),PCR优先扩增了较小而非较大片段的已知效应,这有可能潜在地歪曲了真实的等位基因比率。再则,对孕妇和胎儿片段间尺寸分布使用了二分法,这也使这2个DNA群体出现了线性和指数不同的扩增量,从而进一步歪曲了等位基因比率。作为一种替代方法,我们已经开发并验证了被称为循环单分子扩增和重测序技术(cSMART)的新型NIPT法,其中对具有独特条形码的预扩增单个等位基因分子进行靶向测序,但只计算一次,消除了潜在的PCR尺寸偏倚,并允许对原始血浆样品中的突变等位基因进行更精确地量化(图1)。
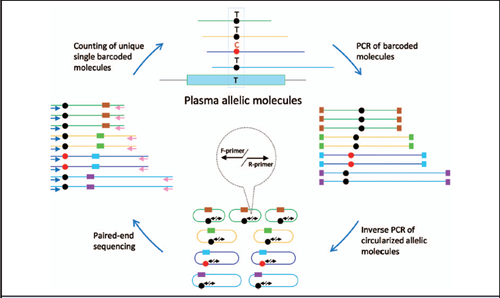
图1.对血浆中等位基因突变体进行定量检测的cSMART法的概念。
单个等位基因分子(彩色线)通过其独特的条形码(彩色框)和/或独特的起始/停止序列识别。对靶向分子进行测序和对独特的分子进行计数,以确定原始血浆中的等位基因比率。
为了获取概念性证据,我们在4例存在肝豆状核变性(WD)遗传风险的妊娠中使用了我们经过验证的cSMART测定法。WD是一种罕见的铜代谢紊乱的常染色体隐性遗传疾病,能够导致肝损伤和神经系统紊乱,并会导致偶发性眼、肾和心脏病变(24,25)。致病基因ATP7B(ATP酶,Cu++转运,β多肽)包括21个外显子和编码铜转送蛋白的一个基因,这种蛋白依赖于储存在ATP中的能量(26)。在这里,我们的目的是表明,由cSMART分析法通过母体血浆样品检测的胎儿基因型与通过有创检测法确定的原始基因型一致。因为事先仅需要知道父母的致病性突变,所以我们认为,在无创产前检测中,cSMART法是单基因疾病的一种可靠并且准确的新方法,具有广阔的前景。
材料和方法
研究设计
本研究经过了中国湖南省中南大学医学遗传学国家重点实验室伦理委员会批准(批准文号2012S042)。四个包含肝功能异常表现先证者的家族同意参加本临床研究(图2)。对先证者进行了临床评估,病理检测结果得出WD的临时诊断。通过Sanger法和全外显子组测序法确定ATP7B的家族性致病性突变。所有4对夫妻出现第二次妊娠,在羊水穿刺后,由Sanger测序对胎儿DNA进行基因分型。我们进行了回顾性分析,通过我们已经验证的cSMART测定法对冻存母体血浆进行NIPT。

Sanger测序
通过引物3程序设定ATP7B(26)外显子1-21扩增的特异性引物(27),把这些引物用于PCR反应,产生4个WD家谱外显子片段。把通过染色终止的测序产物在3100遗传分析仪(Applied Biosystems)中进行电泳,通过DNASTAR Lasergene7.1软件分析外显子序列。
全外显子组测序
简而言之,通过超声对基因组DNA进行片段化处理,对于含有外显子的片段,使用SureSelect靶向富集试剂盒(安捷伦科技),根据制造商的标准说明书进行采集。在Illumina High Seq2500平台的配对末端测序中采用资料库数据。在去除劣质的有错误的FASTQ测序读数(从两个配对末端的Phred质量评分<20< span="">)后,我们把剩余的优质序列与人类参考基因组(hg19)与Burrows-Wheeler校准仪(0.7.5a版)进行比对(28)。在对WD家谱的全外显子组进行测序后,把编码序列一致的覆盖率数据在http://www.clinchem.org/content/vol61/issue1、这篇在线版论文附带的补充表1(全外显子组)、网上补充表2(WD外显子)上发表。
ATP7B等位基因变异体的检测和特征
我们通过Sanger和全外显子组测序数据,用GATK HaplotypeCaller算法识别单核苷酸多态性(SNP)(29)。所有变异体用ANNOVAR标注(30)并在dbSNP138、千人基因组和ESP6500数据库寻找匹配。ATP7B基因的变异体,无论是良性或致病性,都用SIFT和Poly -Phen2(32)算法(31)来识别,以评估对ATP7B功能域的影响。最后,我们把致病性变异体和人类基因突变数据库和肝豆状核变性突变数据库(33)进行比较,来确定它们是已知突变还是新的突变。
通过cSMART进行血浆中突变等位基因的定量
我们通过连接包含独特6bp条形码的通用测序适配器(6,34),从10纳克血浆DNA准备数据库。让改性分子变性并且用Taq连接酶来使单股环化。双向背对背引物以单重或多重方式在靠近突变的位点进行退火,以及进行反向PCR处理来复制靶向等位基因。扩增产物在MiSeq平台(Illumina公司)进行大规模的并行测序,以产生2×200bp的配对末端读数。这一策略的设计目的是捕获所有可能尺寸的等位基因片段,以减少偏倚,但仍然提供足够的匹配序列重叠来组装靶向等位基因。为了导出血浆等位基因比率,我们只对不同尺寸和来自预扩增数据库比对位置的独特条码等位基因计数。在开始和终止测序碱基有1个或更多序列读数相同的情况下,我们只对具有独特条形码的那些进行计数。最终等位基因比率是从最低200个独特条形码等位基因确定的。
结果
先证者的临床评价
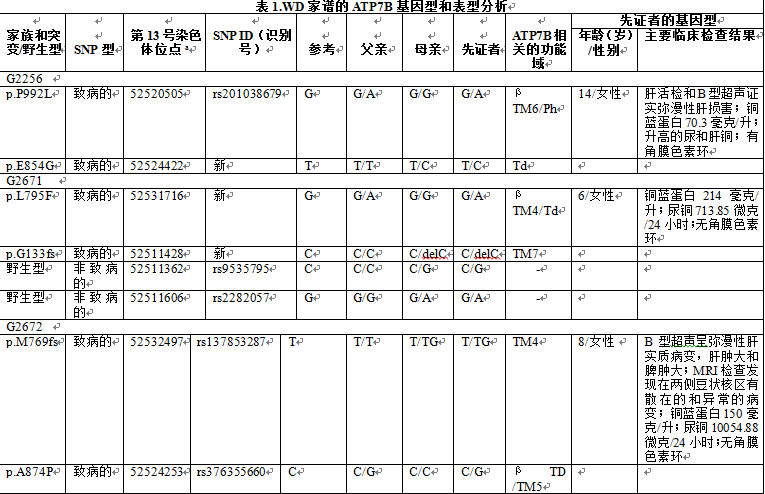
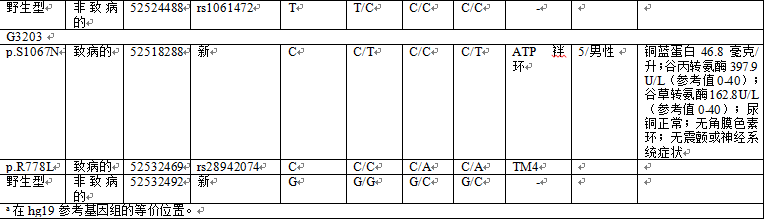
G2256、G2671、G2672和G3203家族(图2)因一个孩子出现可能的肝功能异常征象到过湖南省和辽宁省的不同产前诊断门诊。每个先证者由住院医生进行体格检查、血生化和尿检测(表1)。所有4例先证者循环铜蓝蛋白浓度均降低,并且除了G3203之外,其他所有先证者尿中排泄铜的水平均增高。超声波扫描先证者G2256和G2672发现肝脏病变,包括肝豆状核变性的证据。在眼科检查中,只有先证者G2256出现角膜色素环的证据。基于这些收集的临床症状和异常生化检测结果(表1),每个先证者被给予了WD的临时诊断。
识别致病性WD突变
所有4个家族后来到了湖南家辉遗传专科医院对临床遗传学病学家进行遗传咨询,讨论他们的生育选择。因为所有4对夫妇都准备进行第二次妊娠,所以他们同意参与这项研究,目的在于识别与先证者疾病症状相关的致病性突变,进行一个可靠和准确的有创产前检验,并且评价我们新开发的无创产前检查cSMART法的性能。
在涉及先证者遗传的每对夫妻双方中进行Sanger测序,以识别潜在的致病性ATP7B突变体(表1)。这4对父母即8个人的杂合子突变测序特征显示于图3。其中的6个DNA突变体是导致单个氨基酸替代的无义突变,2个DNA突变体是导致ATP7B酶成熟中被截断的移码突变。鉴于相对于已知ATP7B功能域的蛋白改变的位置和性质,预测所有突变会引起ATP7B酶活性轻度或重度受损(表1)。
全外显子组测序也证实了这8个致病性WD突变。在此基础上,ATP7B WD基因型与先证者相应临床表型的强相关性确认了WD的临时诊断。Sanger法和外显子组测序也在先证者ATP7B外显子区域发现了4个额外的SNP(表1);然而,这些SNP都没有引起氨基酸置换,因此认为是非致病性的。有趣的是,通过家谱分析,SNP包括rs9535795和rs2282057(G2671),rs1061472(G2672),以及一种新SNP(G3203)可以决定性地联系到父亲或母亲WD突变(表1;在线补充图1)。
风险家族WD的产前诊断
随着在先证者中对WD基因型的确认,并且可以使用强有力的产前基因分型检测法,所有4对夫妻决定在第二次怀孕时进行WD的有创产前诊断。在通过Sanger测序对羊水DNA进行分子基因分型后(图3),发现既定的胎儿是p.P992L(G2256)杂合子,G133fs和L792F(G2671)复合杂合子,正常(G2672),和p.S1067N(G3203)杂合子。家族G2671选择终止受影响的妊娠。剩余的3例未受影响的妊娠发育至足月,结果产下无WD症状的健康孩子。
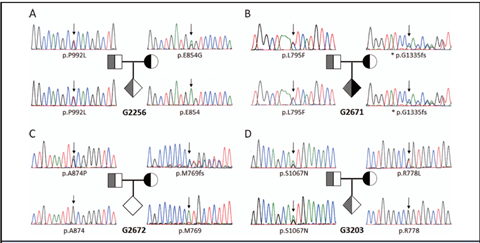
图3. 用Sanger测序进行WD产前诊断。
进行母体血浆突变等位基因量化的cSMART的概念
cSMART法的设计目的是,在限定体积的血浆中,专门针对单个独特等位基因分子的绝对数量进行计数(图1)。我们开发的最终方法涉及标记的单个母体血浆DNA分子的环化,在接近突变位点的背对背引物的退火,反向PCR,然后是对靶向等位基因的大规模平行测序。通过这种方法,可以在从子女有单基因疾病风险的孕妇中收集的原始血浆样品中,对突变等位基因百分率进行定量检测,然后通过简单的孟德尔遗传规律,
可以推断胎儿的基因型(见网上补充表3)。例如,在父母双方带有同样变异的常染色体隐性遗传病风险妊娠中,如果母亲血浆中突变等位基因百分率所占比例过高(>50%)、不足(<50< span="">%)或保持不变(50%),那么胎儿基因型可以分别推断为受影响的纯合子、正常纯合子或正常杂合子。另外一种方法是,如果父亲的突变不同,那么可以直接测量母亲血浆中父亲突变等位基因的百分率。在任一遗传模式中,50%突变母亲等位基因和/或父亲等位基因的百分率偏差将等于胎儿DNA分数的一半。
对胎儿基因分型的cSMART鉴定法的验证
在为WD的无创产前检测进行cSMART检测之前,我们进行验证实验来评估其对预先确定的母体血浆突变等位基因水平进行量化的灵敏度、特异性和再现性。为了模仿父亲WD等位基因的胎儿遗传,我们用来自父亲G3203杂合子的p.S1067N突变掺杂到正常孕妇血浆样品,以便生成0%(对照)、2.5%、5%和7.5%的最后突变等位基因。对于每个最终突变等位基因百分率,我们为每个样品制作一式多份(n=6-8)的样本,来评估对突变等位基因进行定量的准确性和再现性。在为突变p.S1067N设计强有力的靶向引物后,我们应用cSMART法检测,并与实际检测的与预期的突变等位基因百分率进行比较(图4;在线补充表4)。对于0%、2.5%、5%以及7.5%的复制品,实验测定的突变等位基因百分率的均值(SD)分别为0%、2.3%(0.62%)(CV=0.26)、5.59%(0.64%)(CV=0.11)和8.53%(1.43%)(CV=0.16),非常类似于每个突变等位基因百分率的理论值。重要的是,每个复制品的CV值小,并且在2.5%和5%或5%和7.5%复制品之间的范围内没有重叠。此外,对照样品没有产生突变体测序读数,表明该测定法具有特异性。
相反,为了模仿胎儿遗传母亲突变等位基因,我们从孕妇杂合子SNP rs1061472、rs2274084、rs72474224或rs111033313获得了11份母亲样品(图4;网上补充表4),其胎儿遗传了母亲的突变等位基因,因此不管胎儿DNA分数如何,母体血浆中应该有突变的和正常的等位基因平衡(约50%)。在cSMART测定后,在这些样品中突变等位基因的平均(SD)百分率是50.3%(1.07%),CV为0.02(图4),表明cSMART也高度可靠和准确地正确量化了突变母亲等位基因的遗传。
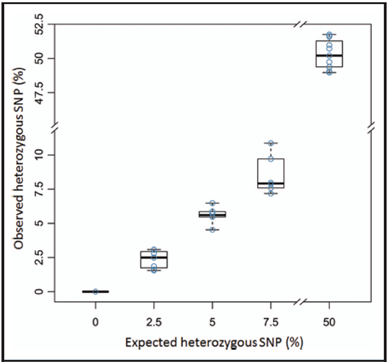
图4.对SNP遗传血浆模型的胎儿等位基因进行量化的cSMART验证
以0%(n=1)、2.5%(n=8)、5%(n=6)和7.5%(n=6)单个突变体父亲等位基因的胎儿遗传通过WD致病突变S1067N而建模,而单个突变体母亲等位基因的胎儿遗传通过SNP位点rs1061472、rs2274084、rs72474224或rs111033313(n=11)而建模。观察对比预计SNP百分率由坐标图显示(中位数黑条)。
最后,为了验证用于检测纯合子受影响胎儿的cSMART法,我们分析了2份血浆样本;从这些样品,知道胎儿遗传了2份SNP rs72474224(样品1)或2份rs80338943(样品2),因此,SNP百分率应大约为50%加胎儿DNA分数的一半(图4;网上补充图4)。在这两个样品中,独立地由母亲杂合子SNP rs2274084协同分析所确定胎儿分数,这个杂合子不是由胎儿遗传的。预期的和由cSMART测定的样品实际SNP百分率是:对样品1分别为57.29%(rs2274084)和55.91%(rs72474224),对样品2分别为56.32% (rs2274084)和58.74% (rs80338943),对两个受影响纯合子胎儿进行了正确的基因分型。
从这些验证研究获取的实验数据也使我们能够评估cSMART测定法的次要性能参数。就反应效率而言,基于每毫升血浆平均10纳克DNA的产出,相当于大约1500个基因组拷贝,我们在2和1毫升血浆样品平均检测到约600和300个分子(35)(见网上补充表4)。对原始血浆样品中的单个血浆DNA分子进行回收和计数,这转化为整体效率10%的级别。这个效率水平在父亲遗传等位基因甚至在最低的胎儿5%DNA分数时,用复制的2毫升血浆模型是可以实现的。为了评估单分子条形码方法,去除与cSMART数据库预扩增和反向PCR步骤相关的任何潜在PCR偏倚的效果,我们检查了从每个验证样品获取的靶向等位基因分子群体尺寸分布的特征。在所有样品中,通过由低覆盖率配对末端测序分析(见网上补充图2)或更深的配对末端测序,我们发现靶向等位基因分子的尺寸分布与随机片段化血浆DNA分子确定的结果非常相似(34)。这为以下观点提供了支持,即建立cSMART测定法的独特单分子条形码策略能有效去除潜在地由分子管线上2个PCR步骤产生的任何显著等位基因定量偏倚。
由cSMART测定法进行的WD无创产前检测
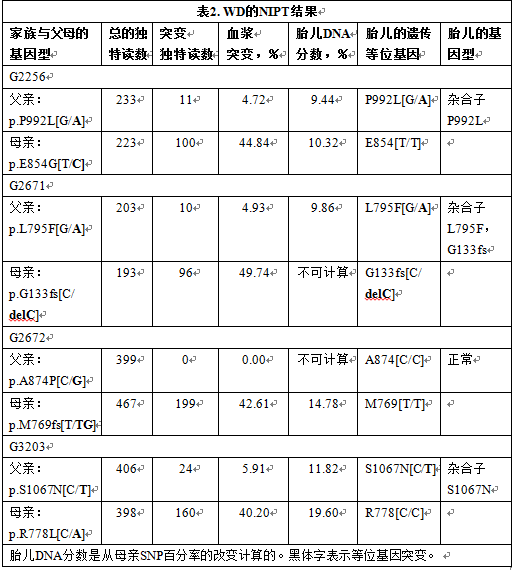
为了确定我们已经验证了的cSMART测定法是否能从母亲血液正确地诊断胎儿WD基因型,我们回顾性分析了夫妇们第二胎妊娠的冻存血浆样本。针对这8个可能存在的WD突变,设计了一个多重引物混合物,以便使相同的cSMART测定法可以普遍适用于每个血浆样品。对没有WD突变的血浆样品的初步测试结果显示,多重靶向测定法对8个正常等位基因产生了数目相当均匀的测序读数,表明多重法在特定的正常等位基因中没有引入任何显著的扩增偏倚。
对于每份怀孕血浆样品,突变血浆WD等位基因的百分率在表2中列出。在妊娠G2256和G3203,检测到4.72%和5.91%的父亲突变等位基因,而母亲突变等位基因百分率结果相似,分别为5.16%和9.8%,对前者产生了平衡效应,显示相应的胎儿是突变p.P992L和p.S1067N的杂合子。相反,对于妊娠G2572,没有检测到父亲突变等位基因,并且母体突变等位基因的比例降低了7.4%,说明该胎儿是正常纯合子。在妊娠G2671,检测到4.93%的父亲突变等位基因,但母亲突变等位基因保持相对不变,为49.74%,表明该胚胎是p.G133fs和L792F的复合杂合子。因此,所有cSMART测定的4个胎儿基因型(表2)与有创产前检测确定的原始基因型一致(图3)。
讨论
在这个试验性研究中,我们提出了无创性新方法诊断单基因疾病的观点,WD是常染色体隐性遗传的一个例证。在4个家谱中,Sanger法和全外显子组测序成功地识别了8个致病性突变,并确认先证者的临床表型为WD。所有8个WD突变是不同的,其中4个(p.R778L、p.P992L、p.A874P、p.M769fs)以前在中国WD患者报道过(36,37);4个(p.E854G、p.L795F、p.G133fs、p.S1067N)在最大的WD突变数据库中没有记录(33),并因此视为新发现的突变。在进行WD临床测试之前的cSMART测定法验证中,我们首先证明,我们可以在胎儿遗传父亲或母亲的血浆模型中和在相应胎儿中,针对2个不同SNP纯合子的两个血浆样品,正确地和可重复性地对突变等位基因水平进行量化。再则,我们确定了cSMART回收单个血浆DNA分子的效率是10%左右,并确定,在胎儿DNA分数低至5%的情况下,可以在2毫升血浆体积中正确的测量等位基因比率。随后,在子女具有WD遗传风险的第二胎临床血浆样品分析中,我们发现,传统有创产前诊断确定的胎儿基因型与我们已经验证了的cSMART法确定的诊断相同。
由cSMART法进行的WD的NIPT检测了2例父亲等位基因遗传,1例正常等位基因遗传和1例两个WD等位基因遗传,代表4种可能遗传模式中的3种。在G303的家族的例子,虽然母亲等位基因的减少没有精确地匹配父亲等位基因的增加,仍然可以明确地识别出正确的基因型。我们推测正常母亲或WD父亲等位基因在通用靶向引物混合物的潜在偏倚可能是一个影响因素。当诊断只依赖于2个父亲突变时,这种观察突出了这个技术可能存在的局限性。例如,某些突变可以位于具有高A和T含量的序列附近,后者不适合于稳健的引物设定。一种可能的解决方案是把测试中的非致病性SNP掺入引物,可在家谱分析中连接到致病性突变。在这方面,对于识别致病性WD变异而且对于检测连接的非致病SNP来说,都证明本研究中应用的全外显子组测序是一种有价值的工具。因此,在把连接SNP的靶向引物加入到最终多重混合物后,对于我们研发的WD cSMART测定法来说,在设计上可能会提高可靠性和准确性。再则,8个引物的靶向混合物证明了cSMART法的高性能,并且提示,升级到引物的更高量级多重复合物后,可能会更加容易的在单次检测中测试广泛的突变。
在成功应用cSMART检测WD的基础上,我们新的测定法在理论上应当同样适用于其它无创产前检测,致病突变可以包括单核苷酸取代或小的缺失或插入的常染色体隐性遗传、常染色体显性遗传和X-连锁遗传疾病。虽然大多数已知的单基因突变可以靶向检测,但有一些疾病其致病突变涉及较大区域的缺失或三核苷酸扩展。例如,杜氏肌营养不良症(DMD)是最常见原因的神经肌肉疾病,致病突变常常涉及缺失1个或多个外显子(38,39)。尽管最近下一代测序方法已经简化了分析,但是由常规分子诊断法识别DMD的致病突变仍然较为复杂(40)。在使用cSMART法的情况下,缺失突变不适合对正常或突变等位基因进行直接与等同的靶向检测。然而,如果已知缺失的起始碱基和/或结束碱基,或连锁SNP能被识别,那么cSMART也可用于DMD的无创产前检测。尽管如此,仍然需要针对其他类型致病突变和/或与常见单基因疾病相关的连接SNP范围进一步开展研究,以便确定cSMART对单基因疾病无创产前检测的总体效用。
总之,cSMART的新量化等位基因靶向方法证实了WD的无创产前检测。作为最低要求,我们的cSMART测定法只需要知晓父母致病突变或连锁SNP,因此在单基因疾病通用NIPT法方面代表了一种具有前景的实验室方法。再则,cSMART可能在早期诊断癌症的新兴领域有更广泛的应用,这需要在血液中准确地定量测量低水平肿瘤特异性循环DNA并且需要监测患者对治疗的产生反应。



